ヒント1:化学構造とは
ヒント1:化学構造とは
化学構造の理論は、原子が互いに有機物質の分子内に配列する順序、原子が相互に作用する相互作用、物質の化学的および物理的性質がこの順序および相互作用からどのように流れ出すかを記述する。

ヒント2:比較的素数は何ですか?
相互素数は単純な数と混同してはいけない数学的な概念です。 2つのコンセプトの共通点は、どちらも部門に直接関係があることだけです。

シンプルな数学は数と呼ばれ、それは1つだけで分割することができます。 3、7、11、143、あるいは1111111 - otdelnosti.Chtobyで指定されたプロパティをそれぞれ有するすべての素数は、相互素数話す、少なくとも二つがあるべきです。この概念は、いくつかの数の共通の特徴を特徴づける。
相対的素数の定義
相互に単純な数字は、例えば、3と5のように1を数えるのではなく、共通の除数を持たない。この場合、個々の数字はそれぞれ個別に単純ではないかもしれない。例えば、2と4に分けることができるので8と11は比較的素数です。ここで定義されている特徴は、正確には、個数の特性ではなく、共通の除数がないことです。ただし、2つ以上の素数は常に互いに素です。相互に素数の場合には、水平線分の形で特別な表記法があり、垂直線が垂れ下がっています。これは、共通の除数を持たないので、共通の方向を持たない垂直の直線の特性と相関します。ペアで相互に素数
おそらく、比較的素数の組み合わせ、そこからは、ランダムに任意の2つの数値を取ることができ、そして、彼らは互いに素であることを証明します。例えば、2、3、および5:ノー公約数は2と3オーディオ、オーディオ2,5または5と3であるこれらの数字は、prostye.Neは常に互いに素の数が互いに素対毎のされている対毎の参照してください。 3 - 例えば、番号15、20及び21 - 15、20、5、15、及び21に分割されているので、互いに素であるが、互いに素であるが、それらに名前を付けることができません。相互に素数の適用
チェーン転送では、原則として、チェーンリンクとスプロケット歯は互いに素数で表現される。これにより、チェーンの各リンクが歯のそれぞれに順番に接触し、機構の摩耗が少なくなります。相互に素数を組み合わせるという面白い特性があります。長さと幅を互いに素数で表現した矩形を描画し、矩形内の角度から45度の角度で光線を描画する必要があります。光線が矩形の側面と接触する点で、最初の光線に対して90度の角度で配置された別の光線を描く必要があります。このような光線を時間の経過とともに作成すると、構造のどの部分も全体に似ている幾何学的パターンを得ることができます。数学の観点から見ると、このパターンはフラクタルである。ヒント3:人間の消化器系とは何ですか?
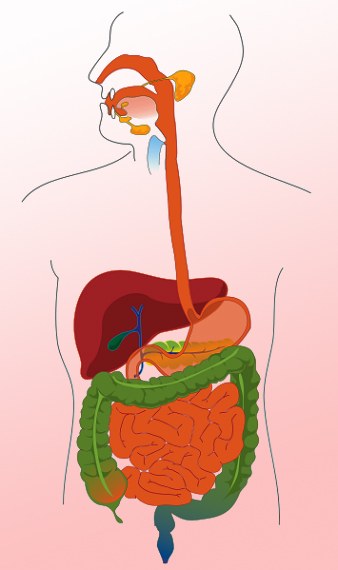
人は生きる必要がある栄養素:タンパク質、アミノ酸、単糖類など。すべてこれは食べ物にありますが、複雑でほとんど消化されない形です。細胞が必要な物質を得るためには、食物を分けなければならない。この作業は消化器系によって行われます システム.
ヒント4:不活性ガスとは
周期律表の不活性ガスは、グループVIIIの主なサブグループ:ヘリウム、ネオン、アルゴン、クリプトン、キセノンおよびラドン(後者は放射性元素である)。これらは希ガスとも呼ばれます。

不活性ガスの電子構造
全ての不活性ガスは完全で安定している外部電子レベルの構成:ヘリウムはダブレット、残りのガスはオクテットです。それらの各々は、周期表の対応する期間を完了する。自然界の不活性ガス
放射性ラドンを除くすべての不活性ガスは、大気中に見い出すことができる。ヘリウムは、水素の後の空間で最も一般的な元素です。太陽は、陽子と反ニュートリノの放出と核融合の反応によって水素から形成されたこの希ガスからなる10%である。貴ガスの物性
不活性ガスは、単原子分子。通常の条件下では、ヘリウム、ネオン、アルゴン、クリプトン、キセノンガスは色や臭いがなく、水に溶けにくい。その原子番号が大きいほど、沸点と融点が高くなります。ヘリウムは独特の性質を持っています。結晶化を起こすことなく、絶対温度ゼロまで液体でもあります。ヘリウムの結晶化は、25気圧の圧力でのみ可能である。さらに、このガスはすべての物質の中で最も低い沸点を有する。希ガスの化学的性質
長い間、不活性ガスは一般に接続を形成しないでください。しかし、特別な条件下で実験的にフッ化物とキセノン酸化物が得られた。その存在は理論家Linus Paulingによって予測された。不活性ガスの使用方法
彼の優れた物理化学物質のおかげで不活性ガスの性質は、広く科学と工学で使用されています。したがって、液体ヘリウム極低温を生じ、そして4の比でヘリウムと酸素の混合物:1人工呼吸雰囲気vodolazov.Poskolkuヘリウムとして使用される - 水素後の最も簡単なガス、それらはしばしば飛行船、気球およびプローブを充填されています。リフトvodoroda.Neon、アルゴン、クリプトン及びキセノンの93%に等しいその持ち上げ力は、照明技術で使用されている - ガス放電管の製造を。電流は、ネオン又はアルゴンガスを充填した管を通過されたときに点灯を開始し、この光の色は、その製品酸素と相互作用する化学反応中に不活性雰囲気を作成するために使用される希ガスの中で最も高価なようgaza.Argon圧力に依存します。ヒント5:原子軌道とは
自然界に存在する物質は、原子と呼ばれる粒子。それらの寸法は非常に小さく、本質的にこれらの粒子は一度も見られず、その構造および特性に関するデータは、様々な複雑な機器を使用する多数の実験に基づいている。

原子の構造
原子は2つの主要な部分で構成されています。 コアと電子シェル。次に、核はプロトンと中性子の組み合わせであり、共に核子と呼ばれる。核の電子殻は電子のみからなる。核は正電荷を持ち、包絡線は負であり、一緒になって電気的に中性の原子を形成する。歴史
以前に言われたように、原子は核と電子動き回ります。多くの場合、概略的な図面を簡略化するために、原子は電子が太陽の惑星の周りの太陽系のように、円形の軌道で移動することを信じています。この視覚的なモデルは、優れた英語の物理学者アーネスト・ラザフォードによって1911年に提案しました。しかし、実験的に証明することはできませんでした、そして用語「軌道」は段階的に廃止されるようになりました。すでに20世紀の初頭30居住で、それが最終的には原子中の電子は、明確な軌道を持っていないことが立証されました。チューンでの軌道の意義の範囲内で近い - 軌道 - アメリカの物理学者ロバートマリケンとドイツの物理学者マックス・ボーン新しい用語をemergeし始めたときです。電子雲
電子雲はポイント全体の集合であり、一定時間電子が移動していた。電子がより頻繁に現れる電子雲の領域は、軌道である。ほとんどの場合、この用語の定義を与え、これが電子の位置が最も可能性のある原子の場所であると言う。ここでは「おそらく」という言葉が重要な役割を果たしています。原則として、電子は原子のどの部分にあってもよいが、軌道の外のどこかにそれを見つける確率は非常に小さいので、軌道は電子雲の約90%であると一般的に仮定されている。図形的には、軌道は、電子の出現が最も起こりそうな領域を描く表面の形で描かれている。例えば、水素の原子の場合、軌道は球形である。軌道の種類
現在、科学者は5つのタイプ軌道:s、p、d、f、g。それらの形は、量子化学の方法によって計算された。現在知られている各元素の原子はすべての軌道の完全な集合を持っていますが、軌道は電子の有無にかかわらず存在します。現代の化学では、軌道は化学結合の形成過程を調べることを可能にする定義概念の1つです。評議会6:価数は何ですか
ヴァレンス - で使用される主な用語の1つ化学構造の理論。この概念は、原子が化学結合を形成する能力を決定し、それが参加するリンクの数を定量的に表す。

指示
1
ヴァレンス (ラテン語から。 valentia - "power")は、分子が他の原子に結合して分子内に化学結合を形成する原子の能力の指標です。原子が参加することができる結合の総数は、その不対電子の数に等しい。そのような結合は共有結合と呼ばれる。
2
非対電子は自由電子原子の外殻であり、他の原子の外部電子と結合している。このような対は電子と呼ばれ、そのような電子は原子価である。このことから、原子価の定義は次のようになるかもしれない:これは、ある原子が他の原子に結合している電子対の数である。
3
ヴァレンス 原子は構造化学式で概略的に描かれている。そのような情報が必要でない場合、原子価が示されていない最も簡単な式が使用される。
4
化学物質の最大価数周期系の1つのグループの要素は、原則として、グループの順序番号に等しい。異なる化学化合物において、1つの元素の原子は異なる価数を有することができる。得られる共有結合の極性は考慮されていないので、原子価には符号がない。それはゼロでも負でもない。
5
任意の化学元素の定量的尺度一価の水素原子または二価の酸素原子の数を考慮することが通例である。しかしながら、原子価の決定において、原子価がよく知られている他の元素も使用することができる。
6
時には原子価の概念は、「酸化の程度」という用語があるが、場合によってはこれらの指標が同じであるにもかかわらず、これは真実ではない。酸化の程度は正式な用語であり、電子対の電子がより電気陰性の原子に移動すると原子が受ける可能性のある電荷を意味する。この場合、酸化の程度は電荷の単位で表され、価数とは対照的に符号を有することができる。この用語は、無機化合物の価数を判断することが困難であるため、無機化学において広く普及している。 ヴァレンス ほとんどの有機化合物は分子構造を持っているので、有機化学でも使用されています。
ヒント7:イオン結合とは何ですか?
イオン結合は変種の1つです陽性および陰性要素の反対に荷電したイオンの間に生じる化学結合である。よく知られているように、イオンは、反跳又は電子の付着の際に原子から形成される正又は負の電荷を有する粒子である。
ヒント8:細胞質とは
細胞質 非常に重要な細胞成分である。 その半液体内部環境において、細胞の重要な機能を担うオルガネラが存在する。細胞質の移動性は、オルガネラ同士の相互作用を促進する。これは、細胞内代謝のプロセスの出現を可能にする。






